近日,暨南大学生命科学技术学院肿瘤分子生物学教育部重点实验室何庆瑜团队在线粒体乙酰化及线粒体自噬研究方面取得重要进展,相关成果于2022年5月在线发表于Redox Biology (IF: 11.8)。

1. 文章概述
何庆瑜团队通过乙酰化蛋白质组学发现去乙酰化酶SIRT1抑制剂能够诱导结直肠癌细胞线粒体蛋白发生多位点乙酰化。在高度乙酰化的线粒体中,调控钙稳态的MCU蛋白K332位点发生乙酰化,导致线粒体钙过度负载及线粒体碎裂,且无法被线粒体自噬所降解清除,从而加速细胞死亡。本研究揭示了原本定位于细胞核的SIRT1蛋白在核外线粒体功能稳态中具有非经典功能(图1)
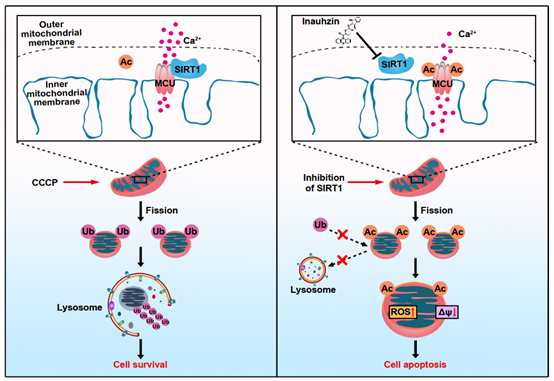
图1. SIRT1抑制剂INZ诱导线粒体功能紊乱机制图
2. 图文导读
蛋白质翻译后修饰(Post-translational modification,PTM)是一种动态且可逆的蛋白质翻译后化学修饰,PTM的失调与细胞代谢、细胞应激、肿瘤恶化等多种生理病理学事件相关。可逆乙酰化是真核生物中最丰富的蛋白质翻译后修饰之一,由乙酰转移酶和去乙酰化酶共同调节。其中,SIRT1是第三类去乙酰化酶家族中最重要成员,主要定位于细胞核,在能量代谢、炎症、氧化应激等方面发挥重要作用。然而,当前对SIRT1的核外调控底物仍然缺少整体性认识。
研究人员使用SIRT1特异性小分子抑制剂Inauhzin (INZ) 处理结直肠癌细胞后,运用定量乙酰化蛋白组学全局性地探究了SIRT1调控的乙酰化网络。结果发现抑制SIRT1能够显著提高线粒体乙酰化水平,揭示了SIRT1在线粒体去乙酰化调控中发挥的非典型作用。SIRT1抑制剂会导致线粒体发生分裂,但阻止了线粒体发生泛素化和LC3募集介导的自噬性降解(图2),表明了SIRT1介导的线粒体去乙酰化在线粒体钙稳态中扮演重要角色。
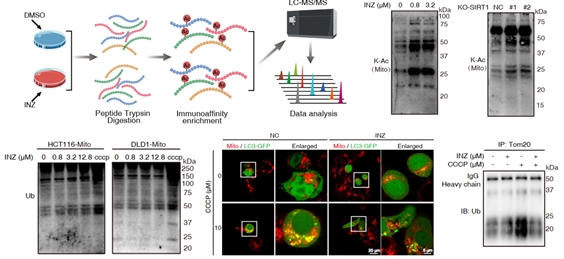
图2. 抑制SIRT1诱导线粒体高度乙酰化
同时,抑制SIRT1会导致线粒体膜电位下降,ROS产生增多,该过程可能是通过SIRT1对线粒体钙单向转运体MCU的调控所实现。研究人员发现MCU是SIRT1的新底物,对SIRT1的抑制促进MCU在K332位点的乙酰化,导致线粒体Ca2+内流增加和线粒体膜电位丢失,最终加重细胞死亡。
综上,本研究揭示了SIRT1在线粒体去乙酰化调控中的非典型作用,为乙酰化和泛素化之间的动态平衡关系提供新线索。
该研究由何庆瑜教授团队独立完成,暨南大学为唯一完成单位,何庆瑜教授、汪洋副研究员为该论文的共同通讯作者,孙月博士生、杨彦铭硕士生为共同第一作者。该研究得到了国家重点研发计划(2017YFA0505100, 2020YFE020220)和国家自然科学基金(82103208)的资助。

